In een recent artikel op de waardevolle site The Conversation vragen Australische onderzoekers zich af in hoeverre we ook in de toekomst kunnen rekenen op antibiotica. Over de hele wereld neemt de resistentie tegen antibiotica toe. Volgens de VN zouden resistente organismen in 2050 wel 10 miljoen sterfgevallen kunnen veroorzaken. Als antibiotica ons niet langer beschermen tegen ziektes, wat kunnen we dan nog doen?
Op deze site hebben we over het onderwerp van ontwikkeling en beperkingen van antibiotica al een hele serie geschreven. Wat zeggen de experts? Hun oordeel staat niet ver af van dat van ons. Laten we eens kijken.
Resistentie tegen antibiotica zal zich helaas altijd ontwikkelen
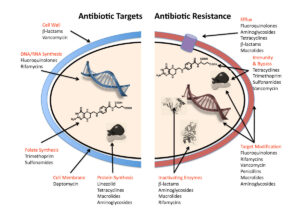
Het probleem met tekortschietende antibiotica heeft een naam: resistentie. ‘Resistentie ontwikkelt zich wanneer bacteriën worden blootgesteld aan concentraties antibiotica die hen niet onmiddellijk doden,’ schrijft Mark Blaskovich. Als ze niet worden gedood, zullen ze een verdediging tegen het antibioticum ontwikkelen. Meer in het algemeen: er zal altijd een zeer klein deel van de bacteriën de behandeling overleven. Daardoor zal resistentie uiteindelijk altijd de kop opsteken – hoewel dit veel sneller zal gaan als het medicijn te kort, of in onvoldoende mate wordt toegediend.
Bacteriën kunnen op een aantal manieren weerstand bieden tegen antibiotica. Ze kunnen dikkere celwanden maken, zodat de stof niet kan binnendringen. Ze kunnen het antibioticum naar buiten pompen zodra dit het organisme binnendringt. Ze kunnen het doel van het antibioticum veranderen en daardoor onkwetsbaar worden voor deze specifieke stof. Of ze kunnen de stof zelf veranderen in een ongevaarlijke variant. Maar Blaskovich blijft optimistisch: bacteriën zijn ‘nog niet’ onoverwinnelijk.
Overdosering
Vaak komt resistentie voort uit een domme of verkeerde manier van toediening van medicijnen, schrijft Allen Cheng. Vaak worden antibiotica een paar dagen te lang voorgeschreven. Dan zijn we tenminste zeker van hun werking. En veel patiënten eisen min of meer van hun arts dat deze hen beter maakt, ook een bron van overdosering. Sommige patiënten kunnen allergisch worden voor penicillines, of zeggen dat te worden. Maar vaak, zo schrijven Winnie Tong en Jacqueline Loprete, wijzen tests uit dat dit niet het geval is.
Onze totale hoeveelheid antibiotica wordt niet snel genoeg aangevuld om te compenseren voor stoffen die het niet meer doen vanwege resistentie. Dat laatste vaak al snel. Zelfs meer dan 98,5% van nieuw ontdekte antibiotica komt nooit buiten de muren van het lab. ‘Het antibiotica-veld staat vol met medicijnen die nooit voorbij de labfase zijn gekomen,’ schrijft Sacha Pidot. Maar er is altijd hoop. In dit geval van een stof die clovibactin heet. Deze werkt op een andere manier. Hij breekt niet de celwand af, waarna ons immuunsysteem het karwei kan afronden. Neen, hij valt de bacteriën van binnen aan. Maar hij is nog niet goedgekeurd voor algemeen gebruik.
Fagen
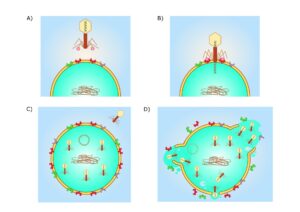
We zouden ook onze toevlucht kunnen nemen tot faagtherapie, zoals beschreven door Christine Carson and Lucy Furfaro. Fagen zijn minuscule wezentjes die bacteriën kunnen infecteren waardoor deze onschadelijk worden. Maar fagen zijn heel specifiek. Ze zullen slechts één bacterie infecteren en de rest ongemoeid laten. En er kan heel wat tijd overheen gaan voordat wij de juiste faag voor een bacterie hebben gevonden. Maar zelfs als we die klus in een paar dagen hebben geklaard, moet de faag nog worden opgekweekt en toegediend. Gebruik van fagen kan daardoor zeer omslachtig zijn. ‘Faagtherapie kost veel tijd, werk en geld. Daardoor wordt faagtherapie snel duur,’ schrijven de auteurs. Maar toch kan de behandeling erg goed aanslaan.
Weerstand tegen antibiotica kan bijzonder groot zijn in ontwikkelingslanden, schrijft Gemma Ware. Ze haalt Nubwa Medugu aan, klinisch microbioloog in Nigeria; deze zegt dat het ‘bijna onmogelijk’ is om in Nigeriaanse ziekenhuizen infecties te vinden die niet resistent zijn tegen tenminste één antibioticum. Nog ernstiger is het dat de weerstand tegen de laatste beschikbare hulpmiddelen toeneemt.
Niet te veel antibiotica
Maar moeten we wel altijd antibiotica innemen? Veel patiënten zien deze als wondermiddelen, en vragen er dan ook naar. Of dokters schrijven ze voor omdat de patiënten ernaar vragen. Ze hebben een belangrijke rol. Maar artsen, zo schrijven Mina Bakhit and Paul Glasziou, moeten zichzelf beperken. Bijvoorbeeld door te werken met beslisbomen om te bepalen of antibiotica echt vereist zijn, door patiënten informatie te geven over de vraag wanneer antibiotica echt nodig zijn, en door een ‘recept met ingebouwde vertraging’ voor te schrijven – alleen te gebruiken als de patiënt niet uit zichzelf beter wordt. Artsen hebben ook iets aan feedback op hun wijze van voorschrijven. Zweden heeft aangetoond dat antibioticagebruik gehalveerd kan worden – sinds eind jaren ’90 kregen artsen informatie van de overheid in een programma tot beperking van het gebruik.
Wat het probleem verergert, zo schrijft Christine Carson, is dat er vergelijkbare problemen zijn met andere ziekteverwekkers: schimmels, virussen en parasieten. Weliswaar komen de door hen veroorzaakte problemen minder voor dan bacteriële infecties. Maar de gevolgen kunnen ernstig zijn. Zoals schimmelinfecties van het bloed, of candidiasis, een infectie van de vulva. En er zijn veel minder antischimmelmedicijnen beschikbaar. En nog minder antivirusmiddelen. Bijvoorbeeld slechts twee voor de behandeling van covid. Bij de antiparasitaire geneesmiddelen is de situatie niet veel beter.
Het probleem van resistentie
Carson schrijft dat het evolutionaire proces dat tot resistentie leidt onontkoombaar is. Toch kunnen we dit zoveel mogelijk voorkómen. Door minder bestrijdingsmiddelen toe te passen tegen ziekteverwekkers. Deze bewaren voor als ze echt nodig zijn; in plaats van ze voor te schrijven ‘voor het geval dat’. Het zijn kostbare middelen. We moeten hun werking zo lang mogelijk behouden, door spaarzaam gebruik. Daarmee kopen we tijd. Tijd die we nodig hebben om nieuwe medicijnen en behandelingen te ontwikkelen voor onze patiënten. Zelfs al gaat dat op dit moment nog vooral om speculatie.
Interessant? Lees dan ook:
Resistentie tegen antibiotica
Chemie versus bacterie. Faagtherapie, een veelbelovend alternatief voor antibiotica?
Nieuwe antibiotica – hun ontwikkeling stagneert. Waarom?
